Wenn eine Mutation in BRCA1, BRCA2 oder in anderen Risikogenen vorliegt, werden den betroffenen Personen in einem ausführlichen Aufklärungsgespräch folgende medizinische Möglichkeiten angeboten:
- intensivierte Früherkennungsuntersuchungen
- vorbeugende Entfernung des Brustdrüsengewebes
- vorbeugende Entfernung der Eierstöcke
Intensivierte Früherkennung von Brustkrebs
Für Frauen, bei denen ein erhöhtes Risiko für Brust- und Eierstockkrebs festgestellt wurde, werden zur Früherkennung von Brust- und Eierstockkrebs, unabhängig davon ob eine Mutation in BRCA1 oder BRCA2, oder in einem der anderen Risikogene vorliegt, folgende Untersuchungen empfohlen:
- ab dem 18. Lebensjahr eine gynäkologische Untersuchung inkl. Palpation, alle 12 Monate
- ab dem 25. Lebensjahr eine MRT (Magnetresonanztomografie), alle 12 Monate
- ab dem 35. Lebensjahr eine Mammografie, alle 12 Monate
- der Brustultraschall wird bei Bedarf durchgeführt
Durch den gemeinsamen Einsatz von Mammografie und Magnetresonanztomografie werden 9 von 10 Brustkrebstumoren früh erkannt. Nur die Kombination der beiden Untersuchungsmethoden gewährleistet eine zuverlässige Diagnosestellung, da jede der Untersuchungsmethoden jeweils andere Veränderungen besonders gut darstellen kann.
Selbstuntersuchung
Jede Frau sollte einmal im Monat ihre Brüste selbst untersuchen.
Der beste Zeitpunkt dafür ist nach dem Ende der Monatsblutung. Ihre Frauenärztin/Ihr Frauenarzt zeigt Ihnen gerne, wie die Selbstuntersuchung durchgeführt wird. Die Selbstuntersuchung kann jedoch andere Früherkennungsmethoden nicht ersetzen!
Mammografie
Die Mammografie ist eine Röntgenuntersuchung. Vor der Röntgenaufnahme wird die Brust zwischen zwei Plexiglasscheiben zusammengedrückt („Kompression“). Das kann unangenehm, manchmal sogar ein wenig schmerzhaft sein, ist aber notwendig, um Veränderungen in der Brust gut erkennen zu können. Außerdem kann durch die Kompression eine niedrigere Strahlendosis verwendet werden. Wenn sie mit modernen Geräten durchgeführt wird, hat eine Mammografie nur noch eine geringe Strahlenbelastung. Sie entspricht in etwa jener Strahlungsdosis, der man auf einem Flug von Wien nach New York ausgesetzt ist.
Brustultraschall
Bei dieser Methode wird die Brust mit Hilfe von Ultraschallwellen untersucht. Dabei wird zuerst Gel auf die Haut aufgetragen, dann wird mit einem Schallkopf über die Brust gestrichen. Die Ultraschalluntersuchung („Mammasonografie“) verursacht keine Strahlenbelastung und ist schmerzfrei. Allerdings ist diese Methode der Mammografie und der Magnetresonanztomografie bei der intensivierten Früherkennungsuntersuchung deutlich unterlegen und wird bei Frauen mit krankheitsrelevanten Veränderungen in BRCA1 und BRCA2 bzw. in anderen Risikogenen nur bei Bedarf eingesetzt.
Ärztliche Brustuntersuchung („Palpation“)
Die Frauenärztin/der Frauenarzt tastet beide Brüste und die Achselhöhlen systematisch ab, um mögliche Veränderungen festzustellen. Diese Untersuchung ist keinesfalls als Ersatz für eine Mammografie oder Magnetresonanztomografie (MRT) anzusehen.
Magnetresonanztomografie (MRT)
Bei einer Magnetresonanztomografie (auch als MRT, MRI oder Kernspintomografie bezeichnet) wird zuerst eine Flüssigkeit (Kontrastmittel) in eine Vene gespritzt. Danach werden mit Hilfe von Magnetfeldern Aufnahmen des Brustgewebes gemacht. Die Untersuchung sollte zwischen dem 8. und 12. Tag des Menstruationszyklus durchgeführt werden und verursacht weder Strahlenbelastung noch Schmerzen.
Manche Frauen empfinden es allerdings als unangenehm, eine halbe Stunde in der engen MRT-Röhre zu liegen. Es gibt verschiedene Methoden, die dabei helfen können, mit dieser Situation umzugehen (z.B. Entspannungstechniken).
Früherkennung von Eierstockkrebs
Leider gibt es heute noch keine zuverlässige Untersuchungsmethode, die zur Früherkennung von Eierstockkrebs geeignet ist.
Dennoch bieten wir folgende Untersuchungen für Frauen mit einem genetischen Risiko, die sich ihre Eierstöcke nicht vorbeugend entfernen lassen möchten:
Tumormarker
Tumormarker sind Stoffe, die im Blut oder anderen Körperflüssigkeiten nachweisbar sind und auf das Vorhandensein bestimmter Krebstumore hinweisen. Sie sind nicht sehr spezifisch und können beispielsweise auch bei gutartigen Erkrankungen erhöht sein, andererseits können normale Tumormarkerwerte einen Eierstockkrebs auch nicht völlig ausschließen. Für diese Untersuchung wird eine Blutprobe abgenommen und auf das Vorhandensein des Tumormarkers CA-125 untersucht.
Vaginal-Ultraschall
Bei diesem Verfahren wird ein Ultraschallstab in die Scheide eingeführt um die Eierstöcke und die Gebärmutter hinsichtlich Form, Größe und Struktur zu beurteilen. Leider ist diese Untersuchungsmethode nur sehr eingeschränkt zur Früherkennung von Eierstockkrebs geeignet.
Früherkennung beim Mann
Auch wenn bislang keine aussagekräftigen Studienergebnisse in Bezug auf die Früherkennung des männlichen Brustkrebses bei Männern mit einer Mutation in BRCA1 oder BRCA2 vorliegen, so wird doch die regelmäßige Selbstuntersuchung empfohlen. Zur Sinnhaftigkeit von Brustkrebs-Früherkennungsuntersuchungen bei Mutationen in anderen Risikogenen gibt es derzeit international zu wenig Daten. Ein Brustultraschall wird nur bei einer unklaren ärztlichen Brustuntersuchung durchgeführt.
Wir empfehlen, gemäß der Österreichischen Krebshilfe, ab dem 40. Lebensjahr jährlich zur Prostatauntersuchung zu gehen. Die Prostatakrebs-Früherkennungsuntersuchung umfasst die Tastuntersuchung durch die Ärztin/den Arzt und den PSA-Test (Prostata Spezifisches Antigen).
Weitere Früherkennungsuntersuchungen, welche bei beiden Geschlechtern empfohlen werden:
Einige der Brust- und Eierstockkrebs-Risikogene erhöhen insgesamt die Wahrscheinlichkeit an Krebs zu erkranken. Wenngleich die Risikoerhöhung in vielen Fällen unbestritten ist, so ist die klinische Bedeutung des erhöhten Risikos oft nur gering ausgeprägt. Aus diesem Grund werden bei BRCA1 und BRCA2, sowie bei den meisten anderen Risikogenen, außerhalb des Brustkrebs-Früherkennungsprogramms spezielle Früherkennungsuntersuchungen nicht empfohlen. Für alle anderen Krebserkrankungen gelten die Früherkennungsempfehlungen der Österreichischen Krebshilfe, die in diesem Falle besonders genau eingehalten werden sollen.
Vorbeugende Entfernung des Brustgewebes
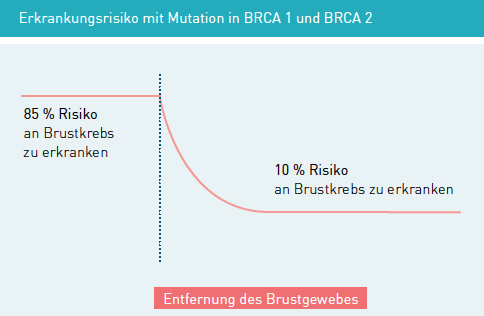
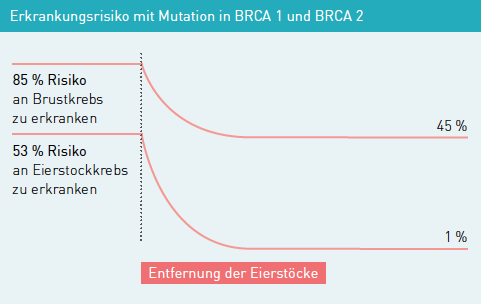
Eine wirksame Möglichkeit, das Erkrankungsrisiko von erblichem Brustkrebs deutlich zu senken, ist eine Entfernung des Drüsengewebes beider Brüste („prophylaktische bilaterale Mastektomie“), möglichst noch bevor eine Brustkrebserkrankung aufgetreten ist. Dadurch kann das Risiko für Brustkrebs um mehr als 90% verringert werden.
Leider ist es in der Praxis nicht möglich, das gesamte Brustdrüsengewebe zu entfernen. Daher kann auch trotz einer prophylaktischen bilateralen Mastektomie in ganz seltenen Fällen später einmal Brustkrebs auftreten.
Für Frauen, die bereits an Brustkrebs erkrankt sind, besteht die Möglichkeit, das verbleibende Gewebe der erkrankten Brust und das Gewebe der anderen Brust vorbeugend entfernen zu lassen. Dadurch wird das Risiko für eine zweite Erkrankung gesenkt.
Im Gegensatz zu BRCA1 und BRCA2 stellt die Entfernung von Brustdrüsengewebe bei fast allen anderen Risikogenen (mit Ausnahme von TP53 und PTEN) keine sinnvolle Methode dar, das eigene Brustkrebsrisiko zu reduzieren. Der Grund dafür ist die Tatsache, dass die Risikoerhöhung durch eine Mutation in diesen Genen das Brustkrebsrisiko nur mäßig oder kaum erhöht. Der Nutzen einer vorbeugenden Operation konnte in solchen Fällen bislang noch nie eindeutig bewiesen werden.
Operation
Bei der Operation dauert die Entfernung des Brustgewebes, je nach Größe der Brust und der verwendeten Technik, etwa 1 bis 2 Stunden. Ein anschließender Brustaufbau dauert je nach der gewählten Methode ca. 1 bis 5 Stunden. Danach ist üblicherweise ein Krankenhausaufenthalt von rund einer Woche nötig.
Wiederaufbau der Brust
Es gibt mehrere Möglichkeiten, eine natürliche Form der Brüste wiederherzustellen:
Implantate (Silikon, Kochsalz)
Die am häufigsten angewandte Methode ist die hautsparende Brustdrüsenentfernung, kombiniert mit einer Sofortrekonstruktion mit Implantaten, welche unter dem Brustmuskel platziert werden. Hautsparende Methoden der Brustentfernung ermöglichen Schnittführungen im Bereich des Warzenhofes oder in der Brustfalte. Bei eher großen, hängenden Brüsten kann die Brust inklusive überschüssiger Haut entfernt und so eine gleichzeitige Straffung erzielt werden.
Vorteile:
- Senkung des Brustkrebsrisikos um mehr als 90%
- psychische Entlastung: Viele Frauen berichten, dass sie sich nach einer prophylaktischen bilateralen Mastektomie sehr erleichtert fühlen, weil sie weniger Angst davor haben an Brustkrebs zu erkranken.
Nachteile:
- Narben können je nach Schnittführung sichtbar sein
- mögliche Komplikationen während oder nach der Operation
- mögliche Beeinträchtigungen des Selbstverständnisses als Frau
- Berührungsempfindlichkeit der Brust wird vermindert
Eigengewebe
Es gibt auch die Möglichkeit des Wiederaufbaus der Brust mit Eigengewebe (z.B. von Bauch oder Rücken), wobei hier eine längere Operationsdauer, eventuell auch Funktionseinschränkungen der Bauch- bzw. Rückenmuskulatur und Narben in der Entnahmeregion in Kauf genommen werden müssen. Dafür kann die Brust in den meisten Fällen ohne körperfremdes Gewebe wieder hergestellt werden.
Vorbeugende Entfernung der Eierstöcke
Da es derzeit noch keine wirkliche Früherkennung von Eierstockkrebs gibt, haben präventive („vorbeugende“) Maßnahmen zur Erkrankungsvermeidung eine besondere Bedeutung. Durch die Einnahme der Antibabypille kann das Risiko an Eierstockkrebs zu erkranken deutlich gesenkt werden. Allerdings geht man davon aus, dass die Pilleneinnahme gleichzeitig zu einer leichten Erhöhung des Brustkrebsrisikos führt. Daher sollten die Für und Wider einer vorbeugenden Behandlung mit Kontrazeptiva in jedem Einzelfall gegeneinander abgewogen werden. Durch die vorbeugende Entfernung der Eierstöcke und Eileiter („prophylaktische bilaterale Salpingo-Ovarektomie“) kann das Risiko für Eierstockkrebs auf etwa 1% gesenkt werden. Leider ist es nie möglich eine Erkrankung völlig auszuschließen, da ein wenig Eierstockgewebe im Körper verbleiben kann.
Operation
Bei vielen Frauen kann die vorbeugende Eierstockentfernung mittels einer sog. Laparoskopie (Knopflochchirurgie) durchgeführt werden. Bei dieser Methode werden 2 bis 3 kleine Schnitte von ca. 1cm in die Bauchdecke gemacht. Ob eine Laparoskopie möglich ist, muss bei jeder Frau individuell entschieden werden. Vor der Operation kann sich die Frau entscheiden, ob die Gebärmutter zusammen mit den Eierstöcken entfernt werden soll oder nicht. In jedem Fall soll die Entfernung der Eileiter erfolgen. Die laparoskopische Operation dauert etwa eine Stunde. Anschließend ist ein Krankenhausaufenthalt von rund einer Woche nötig.
Risikosenkung für Brustkrebs durch vorbeugende Entfernung der Eierstöcke
Die Entfernung der Eierstöcke senkt den Östrogenspiegel im Körper, dies wirkt sich möglicherweise günstig auf das Brustkrebsrisiko insgesamt aus, kann jedoch auch zu Östrogen-Mangelerscheinungen wie einer Verschlechterung der Knochendichte, Libidoverlust, trockener Haut, Haarausfall, Schweißausbrüchen sowie Hitzewallungen führen. Natürlich kann man nach einer Entfernung der Eierstöcke auch nicht mehr auf natürlichem Weg schwanger werden. Da das Risiko an Eierstockkrebs zu erkranken bei BRCA1-Mutationsträgerinnen ab dem 40. Lebensjahr ansteigt, und bei BRCA2-Mutationsträgerinnen ab dem 45. Lebensjahr, entscheiden sich die meisten Betroffenen etwa mit diesem Alter zu einer vorbeugenden Eierstock- und Eileiterentfernung, wenn also die Familienplanung zumeist bereits abgeschlossen ist.
Während man früher glaubte, dass durch eine vorbeugende Entfernung der Eierstöcke auch das Brustkrebsrisiko um etwa die Hälfte verringert wird, so wissen wir heute, dass dieser Schutz allenfalls für Frauen unter dem 50. Lebensjahr gilt, und nur dann, wenn sie eine BRCA2-Mutation tragen.